- Definizione e generalità
Il ferro è l’elemento più importante sulla terra; altamente tossico allo stato libero, rappresenta uno dei minerali più importanti nel metabolismo di tutti i mammiferi e gioca un ruolo molto primario anche nella crescita dell’uomo e in numerose condizioni fisiopatologiche soprattutto nei suoi primi anni di vita.
Il corpo di un adulto contiene 3 – 4 g di ferro.
Il 68% del ferro è contenuto nei quattro gruppi eme dell’emoglobina; il 27% è immagazzinato nella ferritina; il 4% nella mioglobina; lo 0,6% in alcuni enzimi; lo 0,1% circola legato alla transferrina.
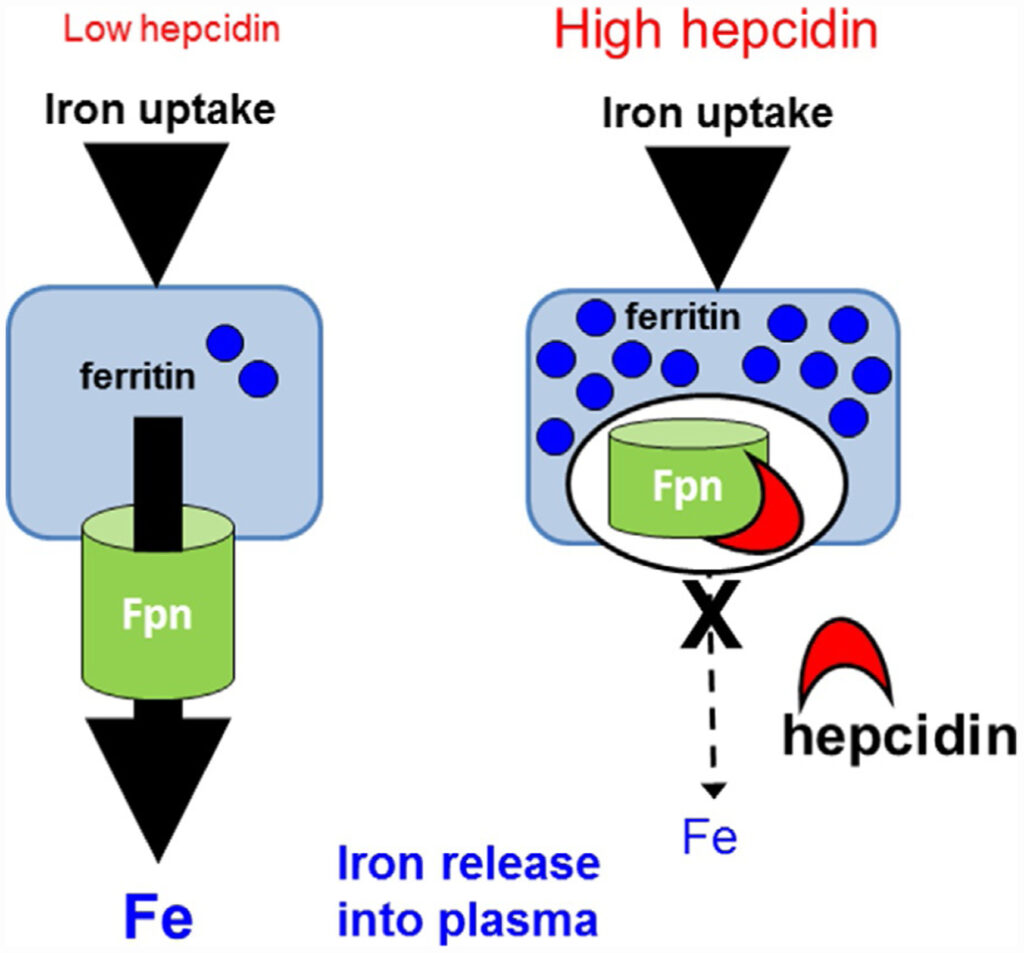
Quando le riserve marziali si stanno esaurendo, la ferritina nel sangue diminuisce e si riduce la saturazione della transferrina. In seguito, diminuiscono i livelli di emoglobina che si manifestano con riduzione del volume e dell’emivita degli eritrociti.
Nei casi di carenza persistente possono comparire gravi effetti a livello metabolico soprattutto a carico del sistema nervoso.
2. Cenni di metabolismo del ferro
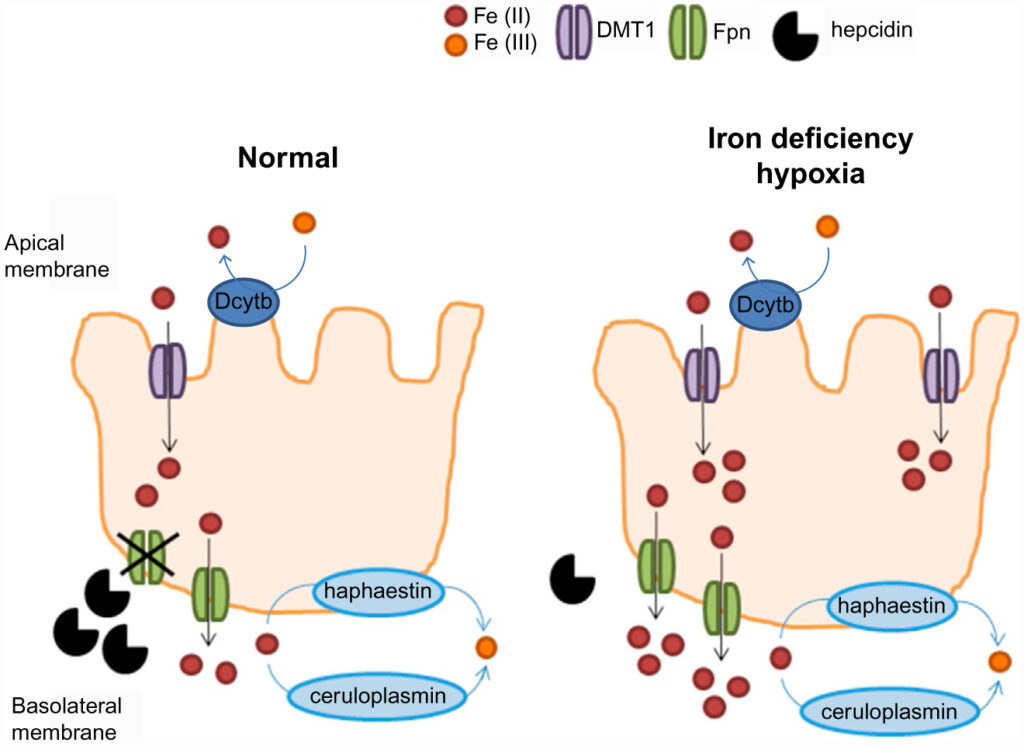
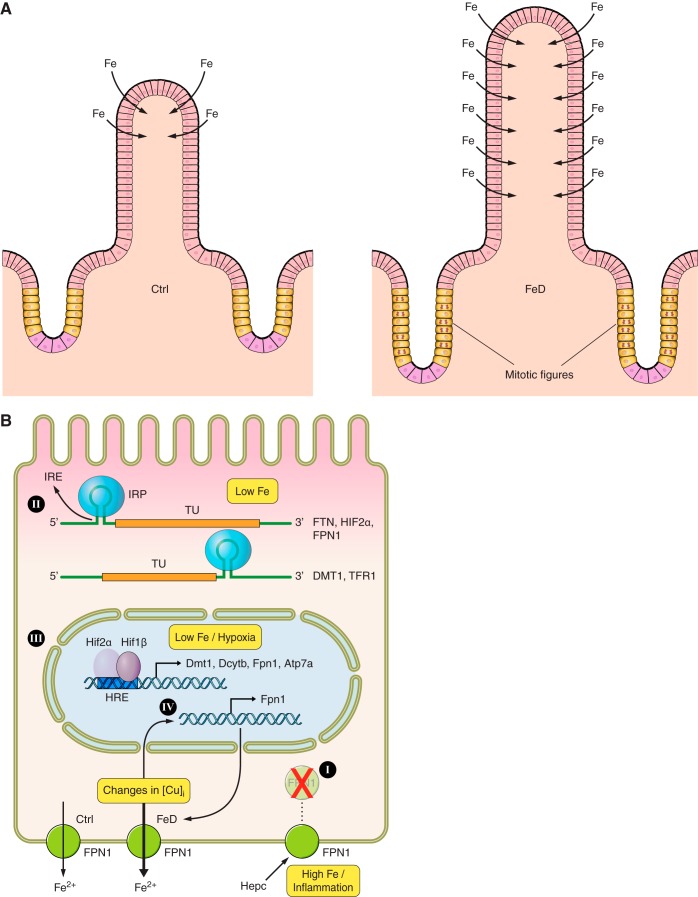
Il ferro alimentare giunge nel lume intestinale in due forme ferro eme e ferro ionizzato ridotto e bivalente (Fe ++) oppure ossidato e trivalente ( Fe +++).
Può essere trasportato all’interno dell’enterocita in forma ridotta (Fe++) o sotto forma di ferro- eme.
Può essere trasportato all’esterno dell’enterocita in forma ridotta (Fe++) o ingabbiata in forma ossidata ( Fe+++) all’interno di una proteina di deposito, la ferritina.
3. Ruolo del ferro negli organi, negli apparati e nelle varie fasi della vita
Si stima che circa due miliardi di persone nel mondo siano anemiche, per lo più durante la prima infanzia, la terza infanzia e la gravidanza.
Nei paesi in via di sviluppo si stima che siano anemici una percentuale fra il 46 e il 66% dei bambini sotto i quattro anni di età e che circa la metà dei casi di anemia sia dovuta alla carenza di ferro (Iron Deficiency Anemia, IDA).
La prima infanzia è un’età particolarmente a rischio sia per il rapido accrescimento quanto per l’assunzione insufficiente.
A livello di popolazione mondiale si stima che il 20 – 25% dei bambini presenti IDA.
La carenza marziale sarebbe un deficit carenziale altamente prevedibile e si osserva prevalentemente nei paesi in via di sviluppo ma è anche l’unico quadro carenziale di micronutrienti che interessi la salute pubblica nei paesi industrializzati.
Possiamo affermare che l’anemia da carenza di ferro è la più comune carenza nutrizionale nel mondo.
Fino a pochi decenni or sono si è creduto che il ruolo del ferro fosse quasi esclusivamente quello del trasporto dell’ossigeno nell’emoglobina e nella mioglobina (ferro – eme).
Negli ultimi vent’anni, con il progredire delle acquisizioni in biologia molecolare, sono state pubblicate numerose ricerche tese a chiarire anche gli aspetti extra ematologici della carenza marziale.
E’ accertato che il ferro svolge un ruolo importante nello sviluppo del sistema nervoso centrale, soprattutto fra il sesto e il ventiquattresimo mese.
Questo periodo è noto come quello dello “scatto” o “spurt” cerebrale.
Sonno REM – con regolari movimenti oculari
Sonno NREM – senza regolari movimenti oculari
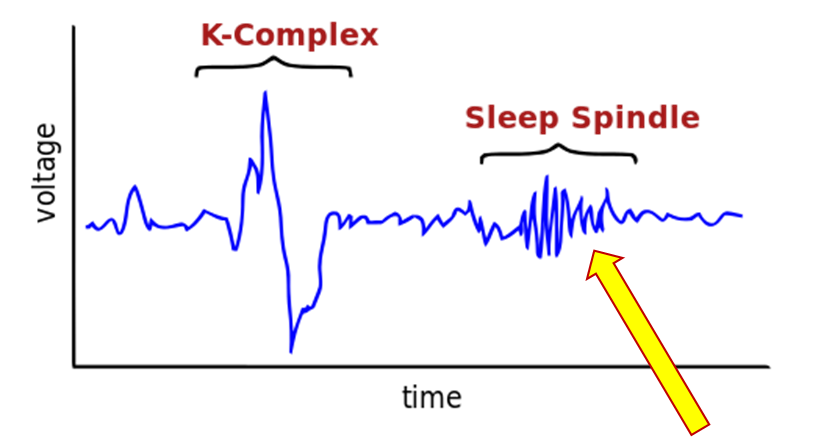
I marcatori del sonno NREM sono i “fusi del sonno”, ovvero delle sequenze di onde di frequenza compresa fra i 12 e i 14 Hz che compaiono all’ EEG fra la quarta e la nona settimana di vita nei neonati a termine e assumono le caratteristiche definitive attorno al terzo mese.
Pare che il ruolo dei fusi del sonno sia quello di trasferire e ordinare a livello corticale i dati immagazzinati provvisoriamente nell’ippocampo.
Il ferro ha un ruolo fondamentale nello sviluppo del sistema dopaminergico che sovrintende al sonno e nello sviluppo della mielinizzazione che aumenta la velocità di trasmissione degli impulsi nervosi.
Alla luce di queste considerazioni la carenza di ferro con le sue implicazioni sullo sviluppo del sistema nervoso centrale è stata correlata con diversi disturbi del comportamento e del sonno.
Pavor nocturnus
Spasmi affettivi
ADHD
Disturbi dello spettro autistico
E’ stato dimostrato che la correzione dello stato carenziale in epoca successiva al ventiquattresimo mese di vita può portare a un miglioramento del quadro clinico nel pavor noctunus, in alcuni disturbi autistici, ma non alla loro completa regressione.
Un lavoro interessante quanto recente sull’outcome a lungo termine della carenza di ferro sembra aver documentato la presenza di svantaggi sociali nei soggetti che hanno presentato carenza marziale ovvero anemia sideropenica durante la prima e seconda infanzia.
4. Formulazione e vie di somministrazione
Le formulazioni a base di ferro sono numerose; per semplicità abbiamo considerato le preparazioni in gocce, particolarmente indicate durante la prima infanzia e agevolmente adattabili al peso del soggetto.
Il contenuto in ferro non è facilmente determinabile dai dati disponibili in rete in quanto buona parte dei prodotti sono registrati come integratori.
Le formulazioni di ferro sono innumerevoli, ma negli ultimi anni le più utilizzate per la somministrazione orale sono state il ferro solfato (Fe++), il ferro polimaltoso (Fe+++) e il ferro bisglicinato (Fe++).
Tutte queste molecole sono efficaci.
La differenza sostanziale è la mancata interferenza del ferro polimaltoso e del ferro bisliginato con la contemporanea assunzione di latte e latticini, che costituisce un limite importante per la somministrazione del ferro solfato durante la prima infanzia.
In termini di efficacia, misurata come aumento della ferritina circolante il ferro solfato e il bisglicinato appaiono più performanti rispetto al polimaltoso.
Il maggior costo dei prodotti basati sul ferro bisglicinato è controbilanciato dalla sostanziale maggior biodisponibilità costituita dalla possibilità di somministrazione indipendentemente dagli orari e dai ritmi dei pasti.
Fra le preparazioni disponibili appaiono particolarmente interessanti quelle che prevendono un micro incapsulamento lipidico del principio attivo (ferro bisglicinato micor – incapsulato o liposomiale ) che permettono al ferro bivalente di raggiungere la mucosa duodenale indipendentemente dal pH gastrico e da eventuali fattori che lo modifichino.
Nelle preparazioni orali di ferro vengono spesso aggiunti Vitamina C, Vitamina B12 e Acido Folico. L’aggiunta di folati inizialmente era stata intrapresa in considerazione che una carenza di acido folico, che notoriamente aumento il volume degli eritrociti (megalociti) avrebbe potuto mascherare una carenza di ferro, che notoriamente lo riduce (microciti).
L’aggiunta di Vitamina B12 è avvenuta per ovviare a stati carenziali di questa vitamina soprattutto durante la gravidanza e il puerperio.
Nel neonato nelle società occidentali uno stato carenziale di Vitamina B12 è un evento eccezionale, fatta salva la possibilità di insorgenza in famiglie con regimi alimentari vegani molto rigidi.
Ricerca recenti hanno però permesso di osservare che la presenza di acido folico e di vitamina B12 può essere utile nella maturazione del sistema immunitario.
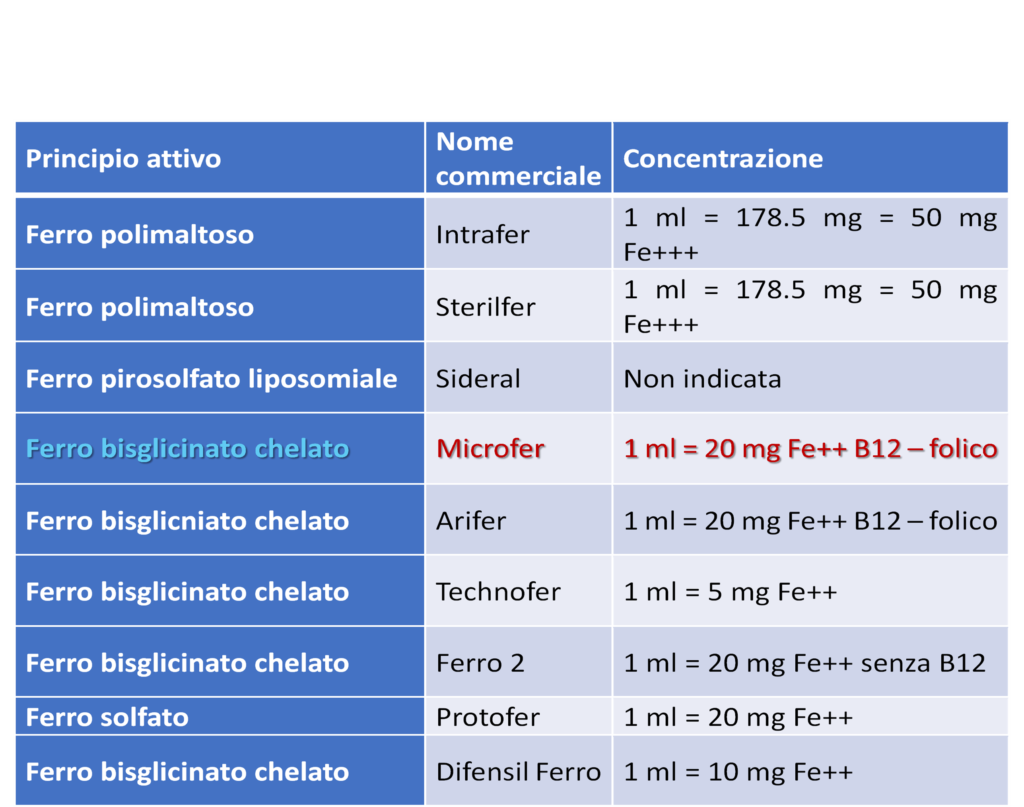
Alcune preparazioni di ferro per os:
Alcune preparazioni di ferro per somministrazione endovenosa:

5. Take home messages
La carenza di ferro e l’anemia sideropenica dovrebbero essere individuate e trattate precocemente , possibilmente ben prima dei sei mesi di vita.
Durante la fase della vita che va dai sei ai dodici mesi, va posta particolare attenzione all’insorgere di un quadro carenziale.
La sua prevenzione potrebbe migliorare la qualità del sonno, lo sviluppo cognitivo e quello del potenziale umano a lungo termine.
Fonte:
Waldvogel- Abramowski S, Waeber G, Gassner C, Buser A, Frey BM, Favrat B, Tissot JD. Physiology of iron metabolism. Transfus Med Hemother . 2014 Jun;41(3):213 – 21.
Ginzburg YZ. Hepcidin ferroportin axis in health and disease . Vitam Horm. 2019;110:17 – 45.
Wang M. Iron Deficiency and Other Types of Anemia in Infants and Children. Am Fam Physician. 2016 Feb 15;93(4):270 – 8.
Peirano PD, Algarín CR, Chamorro R, Reyes S, Garrido MI, Duran S, Lozoff B. Sleep and neurofunctions throughout child development : lasting effects of early iron deficiency . J Pediatr Gastroenterol Nutr. 2009 Mar;48 Suppl 1(0 1):S8 – 15.
Ginzburg YZ Hepcidin ferroportin axis in health and disease. Vitam Horm. 2019;110:17 – 45.
University of Wisconsin Pediatrics Outpatient Clinical Guidelines – 2018.
Hasselmo ME. Neuromodulation: Acetylcholine and memory consolidation. Trends Cogn Sci. 1999; 3:351 – 359.
Yadav D, Chandra J. Iron deficiency: beyond anemia. Indian J Pediatr. 2011 Jan;78(1): 65 – 72.
Kim J, Wessling-Resnick M. Iron and mechanisms of emotional behavior. J Nutr Biochem. 2014 Nov;25(11):1101-1107.
Bagna R, Spada E, Mazzone R, Saracco P, Boetti T, Cester EA, Bertino E, Coscia A. Efficacy of Supplementation with Iron Sulfate Compared to Iron Bisglycinate Chelate in Preterm Infants. Curr Pediatr Rev. 2018;14(2):123-129.
Name JJ, Vasconcelos AR, Valzachi Rocha Maluf MC. Iron Bisglycinate Chelate and Polymaltose Iron for the Treatment of Iron Deficiency Anemia: A Pilot Randomized Trial. Curr Pediatr Rev. 2018;14(4):261-268.
Maggini S, Pierre A, Calder PC. Immune Function and Micronutrient Requirements Change over the Life Course. Nutrients. 2018 Oct 17;10(10):1531.
Wolf M, Rubin J, Achebe M, Econs MJ, Peacock M, Imel EA, Thomsen LL, Carpenter TO, Weber T, Brandenburg V, Zoller H. Effects of Iron Isomaltoside vs Ferric Carboxymaltose on Hypophosphatemia in Iron-Deficiency Anemia: Two Randomized Clinical Trials. JAMA. 2020 Feb 4;323(5):432-443.

